Valerolactama
La Valerolactama (llamada también δ valerolactama o 2-piperidona) es una lactáma del ácido 5-aminovalérico (5-aminopentanoico).
| Valerolactama | ||
|---|---|---|
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 675-20-7[1] | |
| ChEBI | 77761 | |
| ChEMBL | CHEMBL12193 | |
| ChemSpider | 12144 | |
| PubChem | 12665 | |
| UNII | WLN0GQQ6EK | |
| Propiedades físicas | ||
| Masa molar | 99,068 g/mol | |
Se puede preparar con biotecnología sintetizando el ácido 5-aminovalérico con buenos rendimientos. Sirve como materia prima de varias poliamidas, como el poliaminovalerato 5.[2]
Síntesis
El ácido 5-aminovalérico se forma por activación con tiocianato de 2-nitrofenilo y tributilfosfina en dimetilformamida a temperatura ambiente en una ciclización intermolecular para formar la δ valerolactama.[3]

La ciclización del ácido 5-aminovalérico también puede realizarse enzimáticamente .[4]
Durante el calentamiento de sales amoniacales del ácido 5-hidroxivalérico surge también la δ-valerolactama.

La síntesis a partir de poli-δ-valerolactonas en N-metilpirrolidona con Amoníaco a 330 °C y una presión de 280 bar genera la 2-piperidona en los Rendimientos de hasta el 83 %.[5]

La Hidrogenación de glutarimida en un autoclave produce δ-valerolactama con rendimientos de hasta el 70% en el caso de 270 °C y 490 atm en presencia de catalizadores e níquel.[6]

Se puede formar también por la transposición de Beckman de la ciclopentanona:

La transposición de ciclopentanonoximas es, en la fase de vapor en catalizadores de zeolita ácida, más rápida que la de los homólogos ciclohexanonoximas, debido a que la pequeña diferencia de tamaño los vuelve más fáciles de difundir por los poros del catalizador.[7]
La oxidación de Piperidina en Tolueno proporciona δ-valerolactama con rendimientos de aproximadamente 60 %.[8]
Propiedades
La δ-valerolactama sintética presenta un color amarillo-marrón y es un sólido higroscópico. Después de pasar un 50 por ciento en una disolución acuosa de un ácido es un sólido inodoro blanco.[9]
Aplicaciones
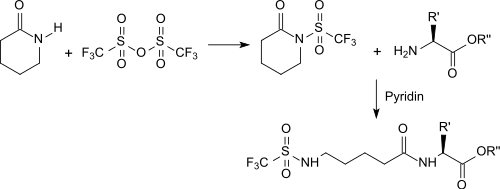
Después de la Activación con anhídrido tríflico, reacciona con el grupo amino de los amino+ácidos para formar una amida como grupo protector.[10]
Se puede acilar con halogenuros de acilo:[11]

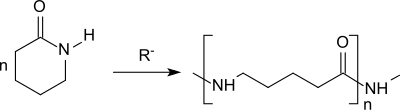
La polimerización aniónica de la δ-valerolactama surge de forma análoga a la homólogos épsilon-Caprolactamas Poliamida 5 (Nylon 5).
Referencias
- Número CAS
- S.J. Park, E.Y. Kim, W. Noh, H.M. Park, Y.H. Oh, S.H. Lee, B.K. Song, J. Jegal, S.Y. Lee. Metabolic engineering of Escherichia coli for the production of 5-aminovalerate and glutarate as C5 platform chemicals. doi:10.1016/j.ymben.2012.11.011.
- P.A. Grieco, D.S. Clark, G.P. Withers. Direct conversion of carboxylic acids into amides. doi:10.1021/jo01330a028.
- E. Stavila, K. Loos. Synthesis of lactams using enzyme-catalyzed aminolysis. doi:10.1016/j.tetlet.2012.10.133.
- Patent EP0670311A2: Verfahren zur Herstellung von Piperid-2-on.
- Patent US3745164: Preparation of butyrolactam and valerolactam.
- T. Takahashi, K. Ueno, T. Kai. Vapor phase Beckmann rearrangement of cyclopentanone oxime over high silica HZSM-5 zeolites. doi:10.1016/0927-6513(93)80048-Y.
- Patent US8212027B1: Process for the conversion of cyclic amines into lactams.
- Patent US2828307: Process for purification of lactams.
- N. Kuhnert, I. Clemens, R. Walsh. On the activation of valerolactam with triflic anhydride: the synthesis of ω-trifluorosulfonamido dipeptides using a transpeptidation reaction under mild conditions. doi:10.1039/B417779G.
- Patent US5405413: Bleaching compunds comprising acyl valerolactam bleach activators.