Durrina
La durrina es un glucósido cianogénico producido por diversas especies de plantas. Fue descubierta en múltiples variedades de Sorghum en 1906 cuando se demostró que el agente causal del envenenamiento de ganado por cianuro de hidrógeno, se debía a la producción de durrina asociada típicamente con Sorghum bicolor. La durrina debe su nombre de la palabra de árabe para el sorgo, transliterado a "Dhura."
| Durrina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
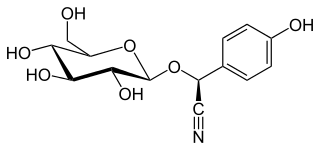
| =(2S)-2-(4-Hidroxifenil)-2-[[(2R,3R,4S,5S,6R)-3,4,5-trihidroxi-6-(hidroximetil)-2-tetrahidropiranil]oxi]acetonitrilo | ||
| General | ||
| Fórmula estructural | Imagen de la estructura | |
| Fórmula molecular | C14H17NO7 | |
| Identificadores | ||
| Número CAS | 499-20-7[1] | |
| ChEBI | 27616 | |
| ChemSpider | 141737 | |
| PubChem | 161355 | |
| UNII | P5999IY65C | |
| KEGG | C05143 | |
|
C1=CC(=CC=C1[C@@H](C#N)O[C@H]2[C@@H]([C@H]([C@@H]([C@H](O2)CO)O)O)O)O
| ||
| Propiedades físicas | ||
| Masa molar | 311,29 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Biosíntesis
Como todo glucósido cianogénico típico, proviene de la modificación bioquímica de un aminoácido a su precursor de aldoxima descarboxilada correspondiente. En este caso, el aminoácido precursor es la tirosina. La deshidratación de la aldoxima genera el arilacetoniltrilo y la acción de una monooxigenasa dependiente del citocromo P71E1 forma la cianohidrina correspondiente. En Sorghum bicolor, la producción de durrina está regulada a nivel transcriptional y varía dependiendo de la edad de la planta y de los nutrientes disponibles. El contenido de durrina dentro de Sorghum bicolor puede ser correlativo a la cantidad de mRNA y proteína traducida de enzimas CYP79Un1 y CYP71E1, dos proteínas intermembranales pertenecientes a la superfamilia del citocromo P450. Mientras que la transcripción y la traducción de estas dos enzimas son relativamente más altas en los primeros días de crecimiento, la transcripción es reducida considerablemente después de una semana de crecimiento. Después de cinco semanas de crecimiento, la transcripción y traducción de ambas enzimas en las hojas se torna indetectable, mientras que en las raíces se mantiene la producción mínima de ambas enzimas.Con la adición de un exceso de nitrato , se incrementa la transcripción de ambas enzimas, aunque no a los niveles vistos en desarrollo temprano.[2] La última enzima en la síntesis de durrina, la p-hidroximandelonitrilo O-glucosiltransferasa (UGT85B1), es una enzima soluble la cual transfiere el sustituyente glucopiranosilo desde la UDP-glucosa a la aglicona de la durrina. y se forma el enlace glucosídico.

Síntesis transgénica
La adición de CYP79Un1 y CYP71E1 a los genomas de Arabidopsis thaliana y Nicotiana tabacum ha sido mostrado ser suficiente para que ocurra la producción de durrina.[3] Esto se ha confirmado cuando al extraer el gen CYP79Un1 del Sorghum bicolor, las plantas carecen de durrina en su contenido. Esta cepa teóricamente podría ser utilizada como cultivo más seguro para cultivos en entornos áridos en donde el sorgo es el único grano disponible . En vitro, la biosíntesis de la durrina ha sido construido en ambos microsomas recuperados de semillas germinadas de Sorghum bicolor. [4]
Toxicidad
Mamíferos
Los intestinos mamíferos contienen múltiples glucosidasas, las cuales hidrolizan eficientemente los enlaces glucosídicos. La hidrólisis del enlace glucosídico de la durrina forma rápidamente la cianohidrina, la cual se degrada al aldehído correspondiente y a cianuro de hidrógeno. Éste es absorbido al torrente sanguíneo. La dosis letal de durrina en los humanos y otros mamíferos es teóricamente alta cuando una molécula de cianuro de hidrógeno se produce por cada equivalente de durrina. El contenido de durrina por masa en sorgo es relativamente bajo con respecto a la masa cruda de la planta. Como tal, para que un ser humano presente síntomas de intoxicación por cianuro de hidrógeno, debe consumir una cantidad considerablemente grande de sorgo crudo. En entornos áridos, el sorgo es la opción mejor para grano de cereal.[5] En el caso de los mamíferos herbívoros, los cuales sí consumen estas cantidades de sorgo crudo, son los organismos más propensos a presentar el cuadro de intoxicación y hasta pérdida del animal por envenenamiento con cianuro.
Como repelente de insectos
En respuesta a daño externo a la raíz, las variedades de sorgo pueden liberar durrina en el sitio de daño. Esta respuesta ha sido observada como una estrategia evolutiva para repeler insectos herbívoros.[6]
Referencias
- Número CAS
- Busk, Peter Kamp (July 2002). «Dhurrin Synthesis in Sorghum Is Regulated at the Transcriptional Level and Induced by Nitrogen Fertilization in Older Plants». Plant Physiology 129 (3): 1222-1231. PMC 166516. PMID 12114576. doi:10.1104/pp.000687.
- Bak, Soren (August 2000). «Transgenic Tobacco and Arabidopsis Plants Expressing the Two Multifunctional Sorghum Cytochrome P450 Enzymes, CYP79A1 and CYP71E1, Are Cyanogenic and Accumulate Metabolites Derived from Intermediates in Dhurrin Biosynthesis». Plant Physiology 123 (4): 1437-1448. PMC 59100. PMID 10938360. doi:10.1104/pp.123.4.1437.
- Kahn, R A (December 1997). «Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum.». Plant Physiology 115 (4): 1661-1670. PMC 158632. PMID 9414567. doi:10.1104/pp.115.4.1661.
- Borrell, Andrew K. (2014). «Drought adaptation of stay-green sorghum is associated with canopy development, leaf anatomy, root growth, and water uptake». Journal of Experimental Botany 65 (21): 6251-6263. PMC 4223986. PMID 25381433. doi:10.1093/jxb/eru232.
- Krothapalli, Kartikeya (October 2013). «Forward Genetics by Genome Sequencing Reveals That Rapid Cyanide Release Deters Insect Herbivory of Sorghum Bicolor». Genetics 195: 309-318. PMC 3781961. PMID 23893483. doi:10.1534/genetics.113.149567.